por Alexandre Iachan – @alexandre.iachan
TITULAÇÃO:
- médico do setor de endoscopia do HC1- INCA
- médico do Serviço de Endoscopia do Hospital Universitário Gaffrée e Guinle
- médico do serviço de Endoscopia do Hospital Glória D’Or
Introdução
As fístulas esofagorrespiratórias malignas (FERMs) são complicações graves de tumores esofágicos (mais de 70% dos casos), pulmonares, mediastinais e de metástases torácicas. Por definição, configuram comunicação anormal entre o trato digestivo e o respiratório. Essa condição leva à aspiração importante, pneumonia recorrente e significativa redução na qualidade de vida. O tratamento endoscópico tem emergido como a principal abordagem paliativa para o manejo dessas fístulas, proporcionando alívio sintomático e prolongamento da sobrevida. É importante salientar que a presença da fístula esofagorrespiratórias maligna na maior parte dos casos se dá em pacientes sem proposta curativa de sua doença e com prognóstico reservado. Nesses casos, a não intervenção e o suporte clínico também são uma opção no contexto da paliação, com conduta individualizada e em decisão compartilhada com paciente e equipe multiprofissional.
Etiologia e Diagnóstico
As fístulas podem se formar como resultado do crescimento tumoral que compromete a parede do esôfago e das vias aéreas, levando à erosão progressiva e à comunicação entre esses sistemas. Todavia, a radioterapia, quimioterapia e o uso prolongado de próteses esofágicas também podem predispor ao desenvolvimento dessas comunicações anormais. Os principais sintomas incluem disfagia, tosse, dispneia, pneumonia recorrente, abscesso pulmonar e queda importante do estado geral. O sinal de Ono, constituído de tosse incontrolável após a deglutição, está muitas vezes presente. O diagnóstico é realizado por meio de tomografia computadorizada com contraste oral, broncoscopia e endoscopia digestiva alta, as quais permitem a localização precisa e caracterização da fístula. As fístulas mais comuns são entre esôfago e traqueia ou brônquio fonte esquerdo. Todavia, também é possível a existência de fístulas esofagoalveolares. Nesse último caso, a terapia endoscópica deve ser utilizada com critério, pois pode afetar a drenagem e agravar infecções pulmonares.
Tratamento Endoscópico
Próteses Autoexpansíveis
O uso de próteses esofágicas metálicas autoexpansíveis (SEMS – Self-Expandable Metal Stents) é a principal abordagem no tratamento endoscópico. A avaliação endoscópica da fístula previamente à colocação de prótese esofágica deve também incluir a avaliação luminal traqueal. Isso é essencial, pois em caso de comprometimento significativo da luz traqueal por tumor, a colocação da prótese esofágica deve ser precedida da colocação de prótese traqueal. Nesses casos, a prótese esofágica pode promover compressão da traqueia e, devido a presença de importante obstrução luminal tumoral, desencadear significativo comprometimento ventilatório ou mesmo insuficiência respiratória aguda, a qual geralmente só reverte com a retirada da prótese esofágica (sempre tenha uma pinça de corpo estranho à mão ao colocar uma prótese esofágica!). A traqueoscopia pode ser realizada no momento da endoscopia digestiva alta ou por broncoscopia em outro momento. No setor de endoscopia do INCA, antes da colocação de prótese esofágica de esôfago proximal ou médio, realizamos de rotina a traqueoscopia com endoscópio ultrafino (nasoendoscópio) ou pediátrico, precedida de anestesia tópica da laringe com lidocaína a 2% instilado diretamente na região com auxílio do endoscópio.
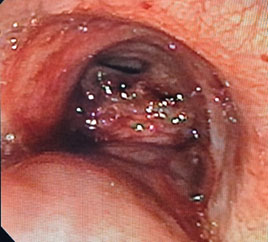
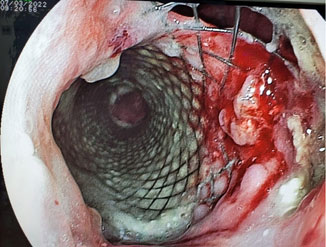
Os stents metálicos autoexpansíveis podem ser totalmente ou parcialmente cobertos. Stents totalmente cobertos reduzem o risco de crescimento tumoral para dentro da prótese (“ingrowth”), mas possuem maior risco de migração. Estudos demonstram que a colocação de stents cobertos pode ser eficaz na oclusão da fístula em mais de 60% dos casos, reduzindo a aspiração e melhorando a qualidade de vida dos pacientes. Já os parcialmente cobertos oferecem maior fixação, pois permitem o crescimento de tecido nas suas extremidades proximal e distal, o que promove o ancoramento definitivo da prótese ao longo de alguns dias. O problema é que esse tecido eventualmente pode levar à obstrução significativa da luz da prótese (geralmente após mais de 4 meses). No contexto de paliação, não se tem a proposta de remover o stent esofágico, então pode-se usar qualquer um dos tipos de prótese (parcialmente coberta ou totalmente coberta). Devido ao risco de migração, a prótese totalmente coberta deve ser utilizada no contexto das FERMs com obstrução luminal esofágica significativa (estenose) que possa promover seu ancoramento – lembrando que esse é o cenário mais comum nesses casos. No uso das próteses parcialmente cobertas em casos sem estenose luminal significativa, podemos lançar mão de mecanismos de fixação provisórios, até haver crescimento do tecido hiperplásico nas extremidades. Em pacientes com estenose esofágica importante, a má-abertura da prótese esofágica pode resultar na adesão frouxa da prótese à parede esofágica e a não vedação adequada, permitindo a passagem de líquido pela lacuna entre a lateral da parte proximal do stent e a parede esofágica. Esse é o chamado fenômeno ou efeito funil. Por esse motivo, além de se respeitar o limite de dois centímetros entre o esfíncter esofágico superior (EES) e o limite superior da prótese esofágica para ela ser tolerada pelo paciente (a presença de corpo estranho próximo ao EES promove muito desconforto), devemos ter um espaço que permita a expansão completa do cálice proximal – idealmente, ao utilizarmos a prótese parcialmente coberta, deve-se estimar pelo menos 4cm desde o EES até o início da parte coberta. Tenho preferido a prótese parcialmente coberta no contexto de paliação (exceto em fístulas cervicais) devido à menor migração e pela vedação da extremidade proximal promovida pelo crescimento do tecido hiperplásico provocado pela malha não coberta, o que acaba por diminuir muito a taxa de “vazamento” entre a prótese e a parede esofágica. As fístulas mais proximais (notadamente cervicais) têm taxa de resposta inferior ao tratamento endoscópico. Para lesões cervicais existem as próteses cervicais totalmente recobertas que apresenta uma copa proximal mais curta, de 7mm, com uma disposição diferente da malha que resulta em menor expansão, propiciando melhor tolerância ao paciente, permitindo o posicionamento da protése em até 1,5 cm do esfincter esofagiano superior.
O stent esofágico, como monoterapia, é preferido devido à facilidade de implantação e menor risco de complicações respiratórias quando comparado ao stent traqueal.
Porém, devemos estar atentos a presença de processos infecciosos pulmonares, abscessos e coleções em curso que podem piorar após a implantação da prótese, recobrindo o orifício fistuloso.
Duplo Stent
Em casos de fístulas grandes, recidivantes ou com estenose traqueal, a colocação combinada de stents esofágicos e traqueais pode ser necessária. Estudos sugerem que a abordagem dupla pode reduzir a mortalidade relacionada às complicações respiratórias, especialmente em pacientes com comprometimento acentuado das vias aéreas.
Outros métodos endoscópicos de tratamento – Clipes Endoscópicos, Suturas, selantes biológicos, dispositivos intracardíacos ou intravasculares e terapia à vácuo
A utilização de clipes endoscópicos, como os Over-the-Scope Clips (OTSC), tem sido explorada como alternativa para pequenas fístulas, proporcionando fechamento mecânico e prevenindo a progressão da condição. Esses métodos são mais eficazes em fístulas pequenas e em pacientes sem comprometimento extenso dos tecidos ao redor. Todavia, na maior parte dos casos das fístulas malignas o tecido esofágico está infiltrado por neoplasia, o que praticamente impede o funcionamento dos clipes. Selantes de fibrina e adesivos biológicos também são utilizados como adjuntos ao tratamento endoscópico. Esses selantes são compostos por substâncias biocompatíveis que promovem a adesão das bordas da fístula, facilitando sua cicatrização. O uso desses materiais é indicado principalmente em fístulas pequenas ou em combinação com outras técnicas, como a colocação de stents. O uso é limitado e questionável nas fístulas malignas. Recentemente, tem-se emergido a possibilidade da utilização de dispositivos de oclusão de defeitos de septo cardíacos ou vasculares (Amplatzer®) em fístulas digestivas como as esofagotraqueais. Existem alguns relatos na literatura da colocação do mesmo com sucesso técnico e clínico. O dispositivo possui arquitetura similar a um carretel, com seu adequado posicionamento consistindo na sua passagem pela fístula e com cada uma de suas extremidades em forma de disco na traqueia ou brônquio e a outra no esôfago, promovendo a oclusão da fístula. Deve ser posicionado com duplo controle endoscópico, por broncoscopia e esofagoscopia. Os maiores problemas encontrados com esse dispositivo foram migração para a via aérea, obstrução da mesma e sangramento. Ele parece ter mais utilidade em casos de fístulas benignas do que malignas. A terapia a vácuo (Endoscopic Vacuum Therapy – EVAC) é uma opção inovadora para a cicatrização de fístulas refratárias, especialmente pós-operatórias, mas sua aplicabilidade nas FERMs é muito limitada.
Considerações Nutricionais
O manejo nutricional é essencial nos pacientes oncológicos. Pacientes com FERMs geralmente apresentam desnutrição devido à disfagia e aspiração recorrente. A nutrição enteral pode ser realizada por sonda nasoenteral ou gastrostomia para evitar a desnutrição e melhorar a resposta ao tratamento. A principal função da prótese esofágica é evitar a aspiração recorrente e melhorar a disfagia, mas não é infrequente ser necessária a suplementação alimentar, a qual em virtude da hiporexia de etiologia neoplásica muitas vezes é realizada por uma gastrostomia previamente colocada. É importante salientar que pacientes em condições clínicas muito debilitadas podem ser tratados de forma conservadora, a qual inclui suporte nutricional enteral.
Prognóstico e Complicações
A sobrevida média após o diagnóstico de uma FERM é inferior a três meses, sem tratamento. Com a colocação de próteses esofágicas, essa sobrevida pode ser estendida para seis meses ou mais, dependendo do estado geral do paciente. As principais complicações incluem migração do stent, dor torácica, refluxo gastroesofágico, sangramento e recorrência da fístula. Após a colocação da prótese esofágica ou a realização de outros procedimentos endoscópicos, é necessário monitoramento rigoroso para avaliar a eficácia do tratamento e prevenir complicações, como a migração da prótese. Em alguns casos, a obstrução da prótese por tecido neoplásico ou restos alimentares pode ocorrer, com necessidade de reintervenção endoscópica.
Conclusão
O tratamento endoscópico é atualmente a abordagem mais eficaz e minimamente invasiva para o manejo paliativo das fístulas esofagorrespiratórias malignas. O uso de stents cobertos ou parcialmente cobertos representa a principal opção terapêutica, enquanto outros métodos têm utilidade bem restrita a casos selecionados. Apesar da alta taxa recorrência e complicações, a abordagem endoscópica melhora significativamente a qualidade de vida dos pacientes e reduz morbidade associada à doença.
Bibliografia:
- Belle A, Lorut C, Lefebvre A, Ali EA, Hallit R, Leblanc S, Bordacahar B, Coriat R, Roche N, Chaussade S, Barret M. Amplatzer occluders for refractory esophago-respiratory fistulas: a case series. Endosc Int Open. 2021 Aug 16;9(9):E1350-E1354. doi: 10.1055/a-1490-9001. PMID: 34466358; PMCID: PMC8367450.
- Cozorici A, Porumb V, Lunca S, Grigoras I, Ristescu I, Jitaru I, Patrascanu E, Gavril L, Dimofte G. TECHNICAL DIFFICULTIES AND PROCEDURAL COMPLICATIONS IN CLOSING MALIGNANT ESOPHAGEAL-RESPIRATORY FISTULAS. Acta Clin Croat. 2021 Dec;60(4):703-710. doi: 10.20471/acc.2021.60.04.18. PMID: 35734501; PMCID: PMC9196228.
- Herth FJ, Peter S, Baty F, Eberhardt R, Leuppi JD, Chhajed PN. Combined airway and oesophageal stenting in malignant airway-oesophageal fistulas: a prospective study. Eur Respir J. 2010 Dec;36(6):1370-4. doi: 10.1183/09031936.00049809. Epub 2010 Jun 4. PMID: 20525708.
- Kim HS, Khemasuwan D, Diaz-Mendoza J, Mehta AC. Management of tracheo-oesophageal fistula in adults. Eur Respir Rev. 2020 Nov 5;29(158):200094. doi: 10.1183/16000617.0094-2020. PMID: 33153989; PMCID: PMC9488631.
- Murthy S, Gonzalez-Stawinski GV, Rozas MS, Gildea TR, Dumot JA. Palliation of malignant aerodigestive fistulae with self-expanding metallic stents. Dis Esophagus. 2007;20(5):386-9. doi: 10.1111/j.1442-2050.2007.00689.x. PMID: 17760651.
- Nehme F, Ge PS, Coronel E. Management of aero-digestive fistulas: the gastroenterologist’s perspective, a narrative review. Mediastinum. 2023 May 16;7:34. doi: 10.21037/med-22-48. PMID: 38090037; PMCID: PMC10713241.
- Silon B, Siddiqui AA, Taylor LJ, Arastu S, Soomro A, Adler DG. Endoscopic Management of Esophagorespiratory Fistulas: A Multicenter Retrospective Study of Techniques and Outcomes. Dig Dis Sci. 2017 Feb;62(2):424-431. doi: 10.1007/s10620-016-4390-0. Epub 2016 Dec 23. PMID: 28012101.
- Spaander, Manon C. W. et al. Esophageal stenting for benign and malignant disease: European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline. Endoscopy 2016; 48(10): 939 – 948. DOI: 10.1055/s-0042-114210
- Wang H, Li W, Wang Z, et al. Chinese expert consensus on interventional diagnosis and management of acquired digestiverespiratory tract fistulas (second edition). Clin Respir J. 2023;17(5):343‐ doi:10.1111/crj.13607

