por Humberto Schwartz
- Membro titular da SOBED
- Membro da ASGE ( American Society for Gastrointestinal Endoscopy)
- Endoscopista Intervencionista do Hospital Unimed Costa do Sol, Macaé
- Responsável pela Ecoendoscopia do Hospital Unimed Costa do Sol, Macaé
· Introdução
O abaulamento recoberto por mucosa normal, geralmente identificado de forma incidental em exames endoscópicos ou radiológicos do trato gastrointestinal (TGI) , podem ser decorrentes tanto de uma massa intramural quanto uma impressão causada por estruturas extramurais. Atualmente, o termo lesão subepitelial (LSE) tem substituído o termo “lesão submucosa”, já que as lesões intramurais podem surgir de qualquer camada da parede gastrointestinal (GI) localizada abaixo do epitélio.
No passado, a prevalência de LSE gástricas suspeitas em endoscopias de rotina era reportada tão baixa quanto 0,36%. Recentemente, a taxa de detecção aumentou de forma significativa, especialmente em relação às lesões pequenas. Os avanços tecnológicos e a maior atenção dedicada a essas lesões podem ser responsáveis por esse aumento.
A ultrassonografia endoscópica (USE) ou ecoendoscopia é atualmente o método ideal na avaliação das LSEs, permitindo identificar a camada de origem, sua extensão, características endossonográficas e diferenciar das compressões extrínsecas contra a parede gastrointestinal. Além de permitir a obtenção de material para patologia.
· Métodos de Diagnóstico
Métodos não invasivos como ultrassonografia transabdominal, tomografia computadorizada e ressonância magnética podem ser utilizados, mas geralmente são insuficientes.
A USE permite visualizar com precisão as camadas da parede GI e definir características endossonográficas, bordas, tamanho e vascularização. A sua acurácia na predição diagnóstica varia de 45,5% a 82,9%. A associação com a punção aspirativa por agulha fina (USE-PAAF) eleva a acurácia para 63% a 98%, (4,5,12).
Avaliação pela USE:
- Camada de origem da lesão (zona de transição).
- Tamanho e padrão ecográfico (bordas, ecogenicidade, homogeneidade).
- Relação com órgãos adjacentes.
- Presença de linfonodos suspeitos.
- Definição de hipótese diagnóstica diferencial.
Tipos de ecoendoscópios – características e aplicações específicas:
1.Ecoendoscópicos Radiais
- Imagem radial (360°), semelhante à tomografia axial.
- Indicados para avaliação diagnóstica inicial de lesões subepiteliais.
- Excelente definição da camada de origem da lesão.
- Limitação: não permitem punção (FNA/FNB).
2.Ecoendoscópios Lineares
- Imagem setorial (100–180°).
- Permite diagnóstico e punções aspirativas (EUS-FNA) ou biópsias (EUS-FNB).
- Indispensáveis para obtenção de material histológico.
- Também permitem terapias guiadas por EUS (injeções, drenagens, marcações).
3. Mini sondas Endoscópicas (USE Miniprobes)
- Transdutores ultrassônicos finos, introduzidos pelo canal do endoscópio convencional.
- Alta frequência (12–30 MHz), com imagens de alta resolução.
- Úteis para avaliação de lesões pequenas e superficiais.
- Limitação: não permitem punção ou intervenção terapêutica.
Identificação das Camadas da Parede Gástrica
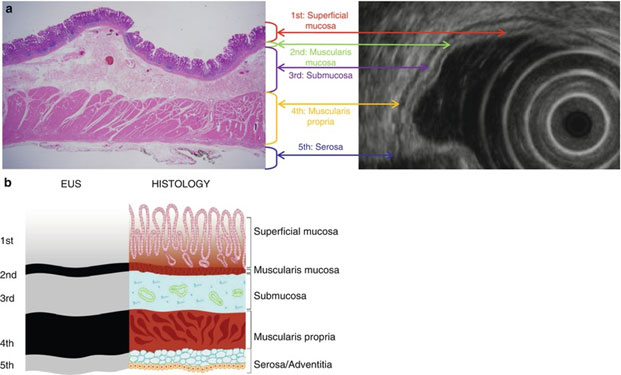
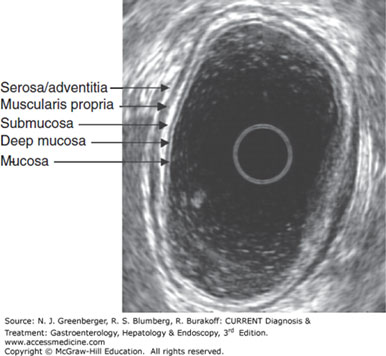
Descrição das Camadas
Na USE, a parede gástrica podemos identificar até 9 camadas distintas, dependendo da resolução do equipamento. Esse modelo é útil para correlação anatômica e caracterização de LSE.
- Superfície luminal / Interface mucosa-lúmen
Hiperecogênica – limite entre lúmen gástrico e epitélio superficial. - Epitélio superficial (mucosa epitelial)
Hipoecogênica – camada mais interna da mucosa. - Lâmina própria + muscular da mucosa (mucosa profunda)
Hiperecogênica – tecido conjuntivo da mucosa e fibras musculares finas. - Muscular da mucosa
Hipoecogênica – separa mucosa da submucosa. - Submucosa superficial
Hiperecogênica – rica em tecido conjuntivo e vasos. - Submucosa profunda
Hipoecogênica – região mais interna da submucosa. - Muscular própria – camada circular interna
Hiperecogênica – primeira porção da camada muscular principal. - Muscular própria – camada longitudinal externa
Hipoecogênica – camada muscular externa. - Serosa / interface serosa-tecido adiposo
Hiperecogênica – revestimento seroso da parede gástrica.
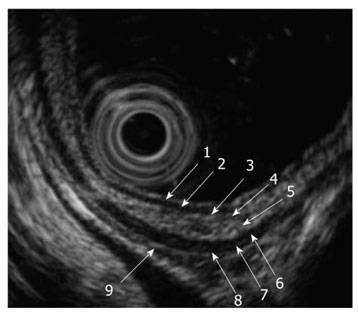
As camadas ímpares (1, 3, 5, 7, 9) aparecem hiperecogênicas.
As camadas pares (2, 4, 6, 8) aparecem hipoecogênicas.
· No exame da LSE
- Examinar cuidadosamente a zona de transição entre a parede gastrointestinal normal e a lesão para determinar a camada de origem.
- Medir o tamanho da lesão e observar o padrão ecográfico (ex.: ecogenicidade, características internas, vascularização e regularidade das bordas).
- Verificar a presença de linfonodomegalias adjacentes.
- Lesões pequenas (< 1–2 cm) podem ser melhor avaliadas utilizando sondas de ultrassom de cateter de alta frequência (Mini Probes).
A instilação de água ou gel no lúmen permite maior acoplamento acústico e melhora da visualização das camadas da parede e avaliação das LSEs, porém devemos estar atentos para o risco de broncoaspiração. A utilização de balão de acoplamento acústico (balão do ecoendoscópio) elimina a interface ar-tecido aumentando a qualidade da imagem.
As informações das características das LSEs fornecidas pela USE, permitem suspeitar de malignidade e auxiliam na decisão sobre ressecção ou acompanhamento. Lesões confinadas às camadas mucosa ou submucosa podem ser removidas com segurança por via endoscópica. A ressecção cirúrgica, quando necessária, é geralmente recomendada para lesões que acometem a muscular própria, embora os avanços em técnicas endoscópicas, como a dissecção endoscópica da submucosa (ESD), e ressecção total da parede (full-thickness resection) tenham tornado possível a remoção por via endoscópica. A USE também pode ser utilizada no acompanhamento após a ressecção (6,8,11).
Quadro 1 – Características ultrassonográficas das lesões subepiteliais
| Causa | Camadas pela USE | Aparência pela USE |
| Tumor estromal gastrointestinal (GIST) | Quarta (raramente segunda) | Hipoecogênico (bordas irregulares, focos ecogênicos com ecogenicidade mista; áreas anecoicas sugerem malignidade) |
| Leiomioma | Quarta, segunda | Hipoecogênico |
| Pâncreas aberrante | Segunda, terceira e/ou quarta | Hipoecogênico ou com ecogenicidade mista (pode haver estrutura ductal anecoica) |
| Lipoma | Terceira | Hiperecogênico |
| Neuroendócrino | Segunda e/ou terceira | Levemente hipoecogênico, homogêneo |
| Tumor de células granulares | Segunda ou terceira | Massa homogênea hipoecogênica com bordas regulares |
| Cisto | Terceira | Anecoico, arredondado ou ovalado (paredes em três ou cinco camadas sugerem cisto de duplicação) |
| Varizes | Terceira | Anecoicas, tubulares, serpiginosas |
| Pólipo fibroso inflamatório | Segunda e/ou terceira | Hipoecogênico, homogêneo ou com ecogenicidade mista, margens indefinidas |
| Tumor glômico | Terceira ou quarta | Hipoecogênico, margens regulares, eco interno heterogêneo misturado com pontos hiperecogênicos |
| Linfoma | Segunda, terceira e/ou quarta | Hipoecogênico |
| Depósitos metastáticos | Qualquer camada | Hipoecogênico, heterogêneo |
Principais Lesões Subepiteliais Gástricas
Pâncreas Ectópico
- Achado incidental em exames endoscópicos de rotina.
- Diagnóstico diferencial: GIST, leiomioma, lipoma, outras SELs.
- Confirmação diagnóstica possível com FNA/FNB quando necessário.
Aspecto endoscópico
O pâncreas ectópico se apresenta como uma lesão subepitelial pequena, de superfície mucosa normal, mas em alguns casos podemos observar umbilicação central — correspondendo à abertura de um ducto pancreático aberrante. Dimensões usuais entre 0,5 e 3 cm e localizadas predominante em antro gástrico, parede pré-pilórica ou curvatura maior (também duodeno e jejuno).
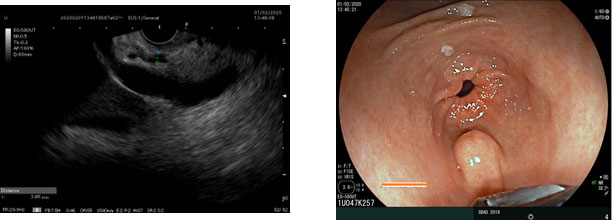
Aspecto endossonográfico
No USE, origina-se na submucosa (3ª camada) ou na muscular própria (4ª camada). Apresenta-se como lesão hipoecoica ou mista, com ecotextura heterogênea devido à presença de ductos e acinos pancreáticos. Muitas vezes nota-se continuidade com a muscular da mucosa, um achado útil para diferenciar de outras LSEs.
· Conduta clínica
A maioria dos casos é assintomática e não requer intervenção.
• Conduta conservadora: acompanhamento clínico e endoscópico, pois o risco de malignização é muito baixo.
• Intervenção: indicada em situações de dor, sangramento, obstrução, pancreatite ectópica, incerteza diagnóstica ou suspeita de transformação neoplásica. Nesses casos pode-se realizar ressecção endoscópica ou, mais raramente, cirurgia.
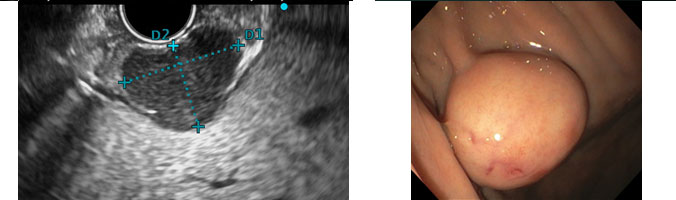
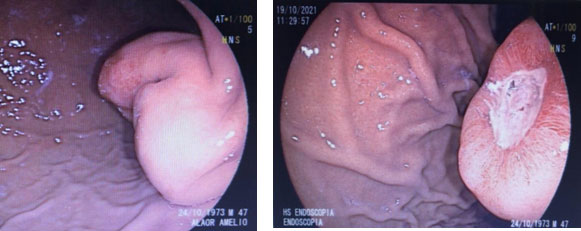
Lipomas
Os lipomas são tumores benignos compostos por adipócitos maduros. Podem ser encontrados incidentalmente em qualquer parte do trato gastrointestinal, sendo mais frequentes no trato inferior. Normalmente são assintomáticos, mas podem ocasionar hemorragia, dor abdominal e obstrução intestinal.
Aspecto endoscópico
A maioria é solitária, apresentando-se como uma elevação lisa de coloração amarelada. São moles e apresentam depressão quando pressionados pela pinça de biópsia (sinal do “travesseiro” ou cushing sign).
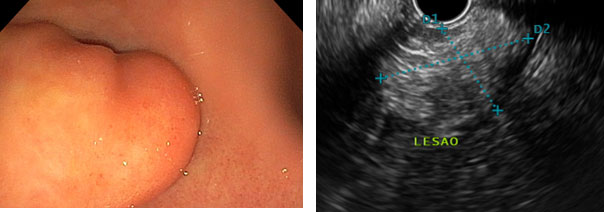
Aspecto endossonográfico
Caracteristicamente, aparecem como lesões intensamente hiperecogênicas, homogêneas, bem delimitadas, originadas da terceira camada da parede gastrointestinal, correspondente à submucosa.
Na maioria dos casos, essas características permitem o diagnóstico. Uma vez confirmado, não é necessário acompanhamento com USE. Lipomas incidentais não necessitam de tratamento. A excisão local é indicada em lipomas sintomáticos (sangramento ou obstrução). A ressecção também é recomendada quando não é possível distinguir entre lipoma e lipossarcoma. Abaixo exemplos diagnosticados com USE setorial e USE radial.
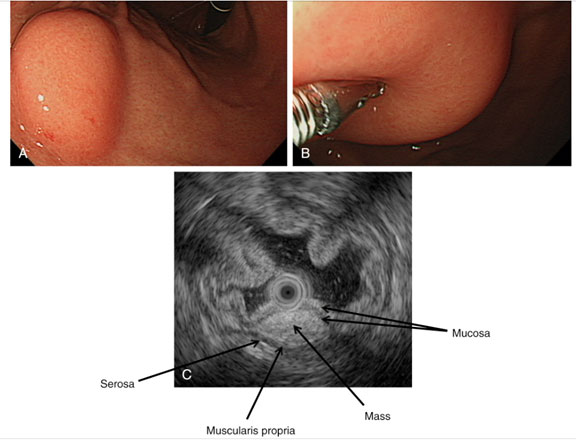
Tumor Neuroendócrinos (TNE)
Os TNEs são neoplasias de crescimento lento, mas com potencial maligno. Podem surgir em diversos locais, principalmente no TGI e no pulmão.
No TGI, costumam ser achados incidentais na endoscopias, cirurgias ou autópsias, originando-se principalmente no apêndice, reto, estômago e intestino delgado. Os TNEs retais são comuns, representando cerca de 20% de todos os neuroendócrinos GI.
Aspecto endoscópico
Lesões pequenas, arredondadas, sésseis ou polipoides, com superfície lisa e coloração amarelada. Costumam apresentar mucosa normal sobreposta e raramente ulceram. TNEs gástricos e ileais são frequentemente múltiplos, enquanto em outros locais geralmente são solitários.
Aspecto endossonográfico
- Origem na segunda camada, podendo invadir além da terceira camada.
- Lesão homogênea, bem delimitada, hipoecogênica leve ou isoecogênica.
A biópsia profunda geralmente confirma o diagnóstico. A USE é fundamental para determinar tamanho, profundidade e extensão, orientando a conduta. Quando a lesão é menor que 2 cm, não invade além da terceira camada e não há linfonodos aumentados, a ressecção endoscópica pode ser realizada
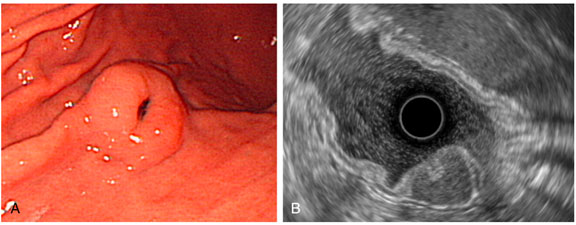
Leiomioma
Os leiomiomas gástricos são tumores benignos originados da camada muscular própria. É uma das principais causas de lesões subepiteliais do estômago. São compostos por células musculares lisas e geralmente de comportamento indolente.
Aspecto endoscópico
À endoscopia, os leiomiomas aparecem como lesões subepiteliais arredondadas, de superfície lisa, geralmente recobertas por mucosa normal. Podem variar em tamanho e são geralmente solitários.
Aspecto endossonográfico
Na ecoendoscopia, o leiomioma gástrico caracteriza-se por uma massa homogênea, hipoecogênica, bem delimitada, originada da quarta camada da parede gástrica (muscular própria). Raramente pode originar da muscular da mucosa (2a camada), podendo ser difícil diferenciar leiomiomas de GISTs apenas pela ecoendoscopia.
Conduta
Leiomiomas gástricos são geralmente assintomáticos e de curso benigno. A ressecção endoscópica ou cirúrgica pode ser considerada em lesões sintomáticas, quando há aumento de tamanho ou quando não é possível excluir diagnóstico de GIST. Nos demais casos, pode-se optar por seguimento periódico com endoscopia e/ou ecoendoscopia.
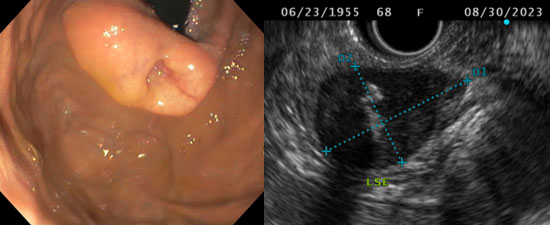
Varizes Gástricas
São decorrentes da hipertensão portal e podem ser confundidas, à endoscopia, com tumores submucosos ou pregas gástricas espessadas. É altamente inadequado e potencialmente perigoso realizar biópsia de uma lesão com essas características, sem antes proceder à avaliação com ecoendoscópica.
Aspectos ecoendoscópicos
- Origem na terceira camada.
• Lesão anecoica, tubular e serpiginosa.
Varizes fúndicas iniciais aparecem como estruturas pequenas, redondas a ovais, anecoicas, localizadas na submucosa. Diferenciação deve ser feita com cistos submucosos, geralmente únicos e não colabam à compressão, enquanto as varizes têm formato tubular e são facilmente compressíveis com o balão do ultrassom.
Varizes gástricas maiores assumem aspecto anecoico, serpiginoso, tubular, com margens lisas, frequentemente acompanhadas de vasos colaterais perigástricos (Fig. 11.12). Em casos graves, cortes transversais de múltiplas varizes fúndicas podem mostrar o padrão “queijo suíço”. A avaliação com Doppler é fundamental para confirmar o diagnóstico pela demonstração de fluxo.
Gastropatia hipertensiva portal
Na gastropatia hipertensiva portal, os achados da USE geralmente são normais, sem alterações intramurais. No entanto, já foram descritos casos com dilatação da veia ázigos, do ducto torácico e espessamento da mucosa e submucosa gástrica.
Comparação entre Endoscopia e USE
A endoscopia convencional é superior para detecção e graduação das varizes esofágicas. Entretanto, a ecoendoscopia é mais sensível para detectar precocemente varizes fúndicas, sendo mais eficaz na avaliação de pacientes com hipertensão portal.
Aplicações terapêuticas da USE
A ecoendoscopia pode guiar a injeção de agente esclerosante em veias perfurantes. Há relatos de sucesso com a abordagem transesofágica guiada por USE para tratamento de varizes gástricas fúndicas, com taxa de sucesso de 96% e boa segurança. A técnica é promissora, pois permite melhor posicionamento do endoscópio, facilita o uso de acessórios e evita manipulação da mucosa gástrica delgada (4).
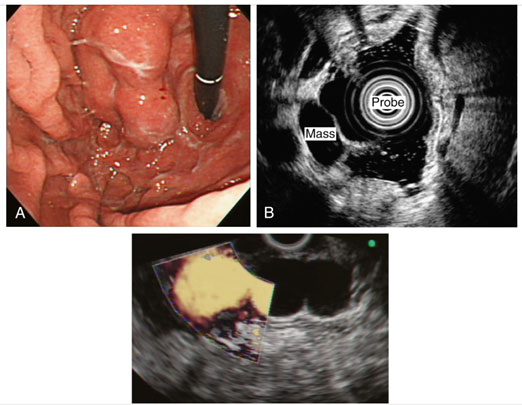
Imagens Dr. Robert Hawes.
Tumor Glômico
O corpúsculo glômico é um receptor neuromioarterial contrátil que atua como termorregulador. O tumor glômico tem origem em células musculares lisas modificadas do corpúsculo glômico. É uma doença rara, geralmente benigna, sendo a maioria localizada no estômago, como achado incidental de LSE. Há raros relatos de tumores glômicos gástricos malignos ou de sangramento associado.
Aspecto endossonográfico
No estômago, o tumor glômico manifesta-se como uma massa hipoecogênica bem delimitada, localizada na terceira ou quarta camada da parede gástrica. Geralmente apresenta padrão heterogêneo interno, com pontos hiperecogênicos misturados. Halo marginal é frequentemente observado.
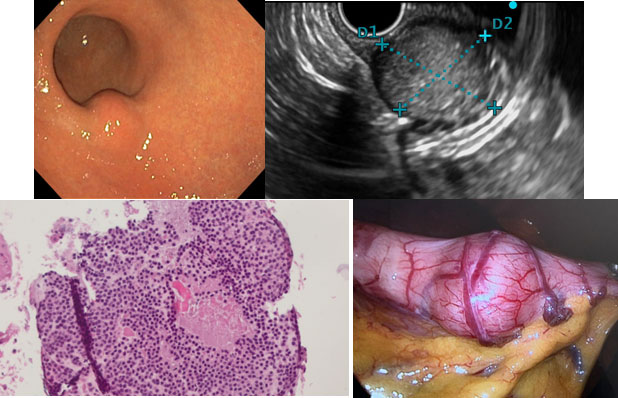
Imagens Dr. Humberto Schwartz.
Pólipo Inflamatório Fibroide
O pólipo inflamatório fibroide é uma lesão polipoide benigna rara, mais frequentemente encontrada no estômago, mas que pode ocorrer ocasionalmente no intestino delgado e, mais raramente, no esôfago ou no cólon.
Na ecoendoscopia, a lesão localiza-se na segunda ou terceira camada da parede gástrica,
Características ecoendoscópicas
- Origem na segunda e/ou terceira camada, com preservação da quarta camada.
- Lesão hipoecogênica, relativamente homogênea, com margens indistintas
Correlação histológica: tecido fibroso proliferado, não encapsulado, com elementos vasculares e infiltrado eosinofílico, localizados nas camadas mucosa profunda e submucosa. Em alguns casos, o padrão interno pode ser heterogêneo ou hiperecogênico. As áreas hiperecogênicas ou pontos brilhantes geralmente correspondem à presença de pequenos vasos sanguíneos.
Imagens Dr. Humberto Schwartz.
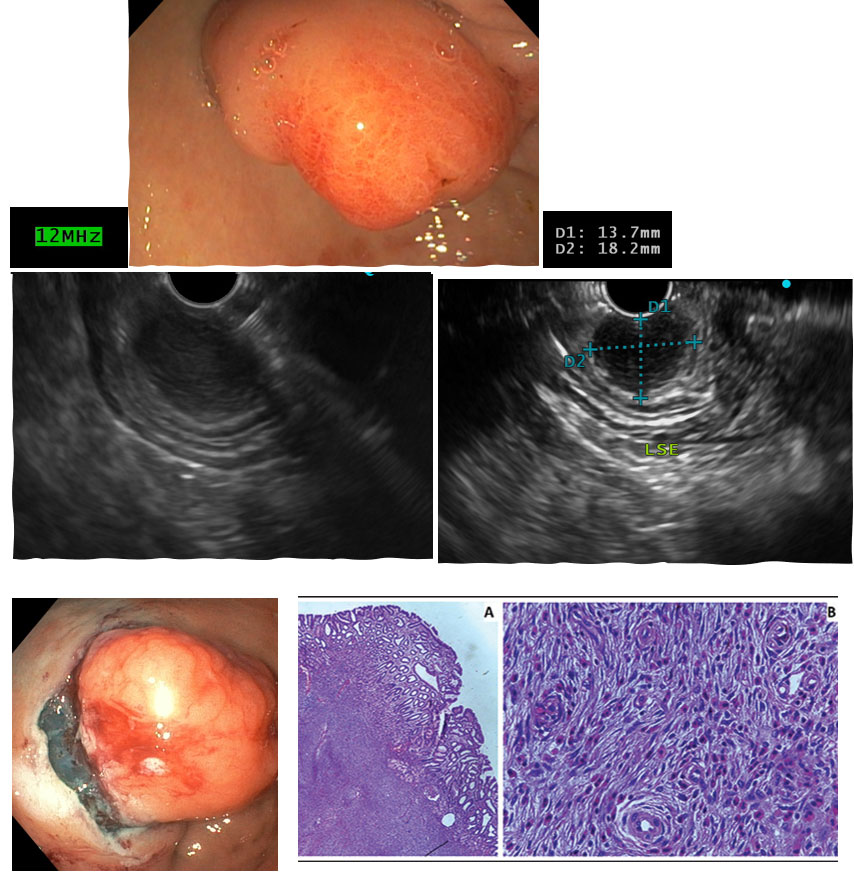
Tumor Gastrointestinal Estromal – GIST
GISTs estão entre os tumores mesenquimais mais comuns do TGI, e são as LSE intramurais mais frequentemente do trato superior. Anteriormente, eram classificados como tumores de músculo liso, como leiomiomas e leiomiossarcomas, devido aos achados histológicos de paliçadas circulares de células fusiformes com núcleos proeminentes e aparente origem na muscular própria.
Características ecoendoscópicas
- Origem na segunda ou quarta camada da parede gástrica.
- Geralmente uma massa bem delimitada, hipoecoica e relativamente homogênea.
- Quando maligno: grande tamanho, padrão de eco heterogêneo com focos hiperecogênicos e/ou zonas anecoicas de necrose.
- Borda extraluminal irregular.
- Linfonodomegalias adjacentes com aspecto maligno.
Aspecto histopatológico e molecular
Com o desenvolvimento de novos marcadores moleculares e melhor compreensão do comportamento biológico, os GISTs passaram a ser classificados como um grupo distinto, porém heterogêneo, de tumores mesenquimais com diferentes graus de diferenciação. As células intersticiais de Cajal, conhecidas como células marca-passo do trato GI, são consideradas as precursoras dos GISTs. Essas células tipicamente expressam o proto-oncogene c-kit (CD117), um receptor tirosina-quinase transmembrana.
Imuno-histoquímica
A maioria dos GISTs é positiva para CD117 (epítopo da proteína kit) e, em alguns casos, CD34, mas negativa para desmina. Leiomiomas, em contraste, expressam actina de músculo liso e desmina, enquanto schwannomas produzem proteína S-100 e enolase neurônio-específica.
Conduta clínica
O manejo dos GISTs depende de fatores como tamanho, localização, risco histológico e presença de mutações. GISTs incidentais de pequeno tamanho podem ser monitorados, enquanto lesões maiores ou com características consideradas de alto risco são indicadas para ressecção. O tratamento pode envolver ressecção endoscópica, cirurgia e, em casos selecionados, terapia alvo com inibidores de tirosina-quinase (ex.: imatinibe), (6).
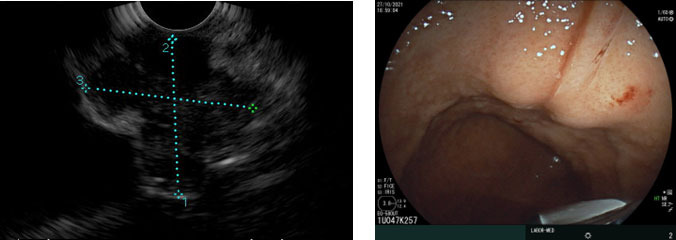
GIST – Sangramento
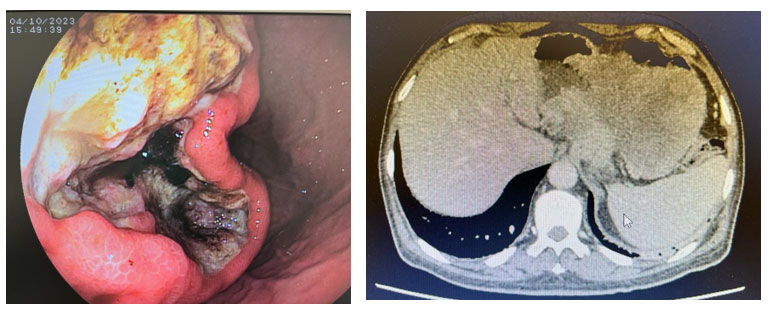
Imagens Dr. Humberto Schwartz.
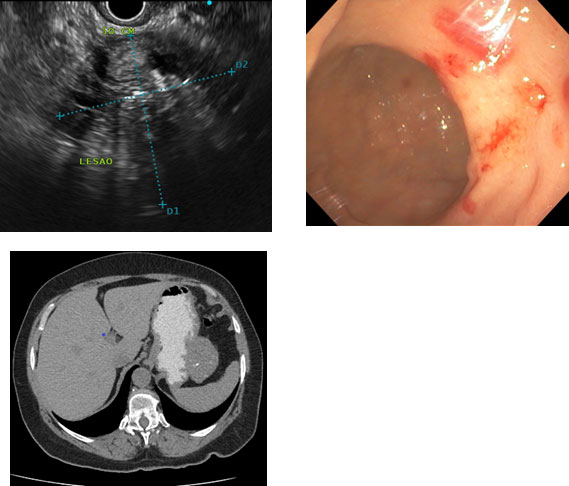
· Compressões – Lesões Extraluminais
Compressões extraluminais, decorrentes de abaulamento por estruturas adjacentes podem simular LSE durante a endoscopia. A diferenciação entre lesão intramural e extrinseca é fundamental, e a ecoendoscopia (EUS/USE) é o método de escolha. (quadro 2). Estruturas anormais, como pseudocistos pancreáticos, aneurismas, tumores císticos do pâncreas ou fígado, tumores de cólon e linfomas também podem produzir impressões visíveis endoscopicamente.
Ao utilizar a USE, a área suspeita de impressão gástrica deve ser observada pelo método em dois passos: 1) com baixa frequência (7,5 MHz), para avaliar a relação geral entre a estrutura extramural e a parede gastrointestinal; 2) com frequência mais alta (12 MHz), para observar cuidadosamente a camada serosa hiperecogênica externa e determinar se está intacta ou interrompida.
- Verificar a integridade das cinco camadas da parede entre a lesão e o lúmen gastrointestinal.
- Identificar impressões causadas por estruturas normais adjacentes versus massas patológicas.
Quadro 2- Compressão extrinseca gástrica – Correspondência no USE
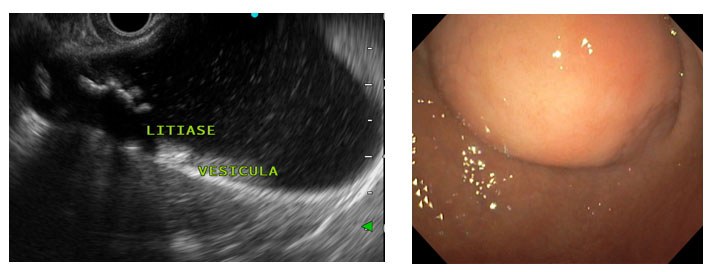
| Causa | Local mais comum no estômago | Dica diagnóstica na EUS |
| Baço (impressão esplênica) | Fundo / curvatura maior | Estrutura homogênea, ecogenicidade idêntica ao baço |
| Vesícula biliar | Antro gástrico | Estrutura anecoica, com conteúdo hiperecogenico (cálculos, lama) |
| Artéria esplênica tortuosa / aneurisma | Corpo / fundo | Lesão pulsátil, fluxo ao Doppler |
| Lobo esquerdo do fígado | Parede anterior / incisura angularis | Ecotextura hepática contínua, sem distorção das camadas gástricas |
| Pâncreas (corpo/cauda) | Parede posterior do corpo/fundo | Parênquima pancreático hipoecogênico em contato direto, sem invasão da parede |
| Linfadenomegalias perigástricas | Corpo/fundo, próximo à pequena curvatura | Lesões arredondadas, homogêneas, fora da parede gástrica |
| Cistos/pseudocistos pancreáticos | Parede posterior | Estrutura anecoica extrínseca, sem origem na parede |
| Tumores hepáticos/esplênicos | Fundo / curvatura maior / parede anterior | Massa sólida adjacente, ecotextura compatível com víscera de origem |
| Diafragma/pilar diafragmático | Cárdia / fundo | Estrutura Hiperecogênica linear contínua com movimento respiratório |
| Abscessos subfrênicos/coleções | Fundo / parede posterior | Lesão heterogênea, hipoecoica, extrínseca |
| Artefatos por distensão gástrica | Vários | Desaparecem após insuflação ou mudança de posição |
Referências Bibliográficas
1) Deprez, P. H., Moons, L., O’Toole, D., Gincul, R., Seicean, A., Pimentel-Nunes, P., Dumonceau, J.M. (2022). Endoscopic management of subepithelial lesions including neuroendocrine neoplasms: European Society of Gastrointestinal Endoscopy (ESGE) guideline. Endoscopy, 54(4), 412–429. https://doi.org/10.1055/a-1751-5742
2) Dhaliwal, A., Kolli, S., Dhindsa, B. S., Devani, K., Ramai, D., Sayles, H., Rangray, R., Bhat, I., Singh, S., & Adler, D. G. (2020). Clinical efficacy and safety of mucosal incision-assisted biopsy for the diagnosis of upper gastrointestinal subepithelial tumors: A systematic review and meta-analysis. Annals of Gastroenterology, 33(2), 155–161. https://doi.org/10.20524/aog.2020.0450
3) Esquema ilustrativo das camadas da parede gastrointestinal. Adaptado de Boyce, G. A., Sivak, M. V., & Rösch, T. (2009). Gastrointestinal endosonography (2nd ed.). Philadelphia: Saunders Elsevier.
4) Hawes, R., Fockens, P., & Varadarajulu, S. (Eds.). (2023). Endosonography (4th ed.). Elsevier.
5) Hedenström, P., Nilsson, O., & Sadik, R. (2018). High clinical impact and diagnostic accuracy of EUS-guided biopsy sampling of subepithelial lesions: A prospective, comparative study. Surgical Endoscopy, 32(3), 1304–1313. https://doi.org/10.1007/s00464-017-5814-9
6) Minoda, Y., Ihara, E., Komori, K., Ogino, H., Otsuka, Y., Chinen, T., Tsuda, Y., Ando, K., Yamamoto, H., & Ogawa, Y. (2020). Efficacy of endoscopic ultrasound with artificial intelligence for the diagnosis of gastrointestinal stromal tumors. Journal of Gastroenterology, 55(12), 1119–1126. https://doi.org/10.1007/s00535-020-01725-4
7) Osoegawa, T., Minoda, Y., Ihara, E., Komori, K., Ogino, H., Otsuka, Y., … Ogawa, Y. (2019). Mucosal incision-assisted biopsy versus endoscopic ultrasound-guided fine-needle aspiration with rapid on-site evaluation for gastric subepithelial lesions: A randomized cross-over study. Digestive Endoscopy, 31(3), 413–421. https://doi.org/10.1111/den.13313
8) Parsa, N., & Gress, F. G. (2009). Normal EUS anatomy. In G. A. Boyce, M. V. Sivak, & T. Rösch (Eds.), Gastrointestinal endosonography (2nd ed., pp. 21–34). Philadelphia: Saunders Elsevier.
9) Sanaei, O., Facciorusso, A., Muscatiello, N., Buonfrate, D., Fathi, P., & Repici, A. (2020). EUS-guided 22-gauge fine-needle biopsy versus single-incision with needle-knife for the diagnosis of upper gastrointestinal subepithelial lesions: A randomized controlled trial. Endoscopy International Open, 8(3), E266–E273. https://doi.org/10.1055/a-1085-9493
10) Sanaei, O., Fernández-Esparrach, G., De La Serna-Higuera, C., Carrara, S., Kumbhari, V., El Zein, M. H., Ismail, A., Ginès, A., Sendino, O., Montenegro, A., Repici, A., Rahal, D., Brewer Gutierrez, O. I., Moran, R., Yang, J., Parsa, N., Paiji, C., Meybodi, M. A., Shin, E. J., Lennon, A. M., Kalloo, A. N., Singh, V. K., Canto, M. I., & Khashab, M. A. (2020). EUS-guided 22-gauge fine needle biopsy versus single-incision with needle knife for the diagnosis of upper gastrointestinal subepithelial lesions: A randomized controlled trial. Endoscopy International Open, 8(3), E266–E273. https://doi.org/10.1055/a-1075-1900
11) Sharzehi, K., Sethi, A., & Savides, T. (2022). AGA clinical practice update on management of subepithelial lesions encountered during routine endoscopy: Expert review. Clinical Gastroenterology and Hepatology, 20(9), 1907–1914. https://doi.org/10.1016/j.cgh.2021.12.034
12) Wong, S. J., Chiu, P. W. Y. Chan, A. W. H., Teoh, A. Y. B., Lau, J. Y. W., & Sung, J. J. Y. (2022). Tissue diagnosis for ≤2 cm EUS-suspected gastric GISTs: A prospective study of endoscopic incisional biopsy. Journal of Gastroenterology and Hepatology, 37(10), 1588–1595. https://doi.org/10.1111/jgh.15925
13) Yamamoto, M., Nishida, T., Uema, R., Kanesaka, T., Ogawa, H., Kitamura, S., Iijima, H., Nagai, K., Tsutsui, S., Komori, M., Yamamoto, K., Tsujii, Y., Hayashi, Y., & Takehara, T. (2024). Utility and advantage of the unroofing technique for gastrointestinal subepithelial tumors: A multicenter retrospective cohort study. DEN Open, 4(1), e332. https://doi.org/10.1002/deo2.332
14) Zoundjiekpon, V., Hladíková, K., Dastych, M., Hlava, Š., & Dvořák, J. (2020). Endosonography-guided fine-needle aspiration versus “key-hole biopsy” in the diagnostics of upper gastrointestinal subepithelial tumors: A prospective randomized interventional study. Biomedical Papers of the Medical Faculty of the University Palacky, Olomouc, Czech Republic, 164(1), 63–70. https://doi.org/10.5507/bp.2019.054

